Estudo foi produzido por Químicos e Biólogos da Unesp de Araraquara e Rio Preto
Um novo composto que inibe a replicação do vírus da hepatite C (HCV) em diversos estágios de seu ciclo – e é capaz de agir também em bactérias, fungos e células cancerosas – foi sintetizado por pesquisadores da Universidade Estadual Paulista (Unesp). O estudo foi descrito em artigo publicado na revista Scientific Reports, do grupo Nature.
“O que fizemos foi combinar moléculas já existentes, por meio de síntese em laboratório, para produzir novos compostos com potencial biológico. Esse método é chamado de bioconjugação. Por meio da bioconjugação, sintetizamos seis compostos e os testamos nos genótipos 2a e 3a do HCV. E conseguimos chegar a um composto com grande potencial terapêutico”, disse o Químico Paulo Ricardo da Silva Sanches, que assinou estudo ao lado da Bióloga Mariana Nogueira Batista, da Unesp de São José do Rio Preto.
O vírus da hepatite C apresenta significativa variabilidade genômica, exibindo pelo menos seis genótipos principais, cada qual com subtipos. Os genótipos 2a e 3a são os subtipos mais comuns do HCV circulante. O composto capaz de destruí-los – o AG-hecate – foi sintetizado a partir do ácido gálico e do peptídeo hecate.
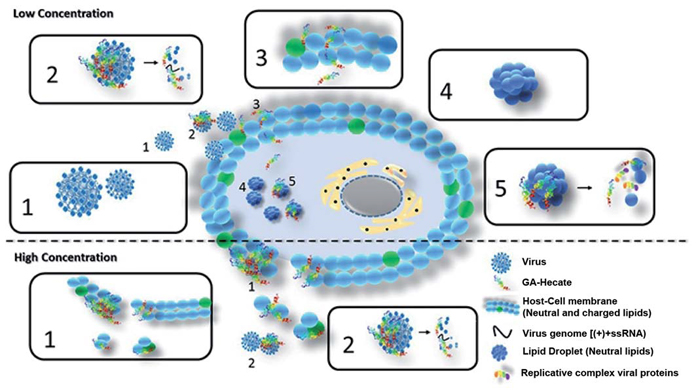
“Descobrimos que esse composto atua em quase todas as etapas do ciclo replicativo do HCV – o que não é uma característica comum nos antivirais. Esses geralmente têm alvos pontuais e isolados, como proteínas do capsídeo, receptores de membranas ou proteínas específicas como a NS3, inibindo processos específicos como a entrada do vírus nas células, a síntese do material genético e de proteínas, a montagem e liberação de novas partículas virais. O AG-hecate, ao contrário, apresentou ampla atividade, agindo em diversas etapas do ciclo”, explicou Sanches.
“O composto também apresentou atividade nos chamados ‘lipid droplets’ – gotas de lipídeo no interior das quais o vírus circula nas células e que o protegem do ataque de enzimas. O AG-hecate desestrutura essas gotas de lipídeo e deixa o complexo replicativo do vírus exposto à ação das enzimas celulares”, prosseguiu.
Os pesquisadores testaram o AG-hecate tanto no vírus completo quanto nos chamados “replicons subgenômicos”, que possuem todos os elementos para a replicação do material genético do vírus nas células, mas são incapazes de sintetizar proteínas responsáveis pela infecção. E o composto foi eficiente em todos os testes.
Outra vantagem apresentada pelo composto foi seu alto índice de seletividade. Isso significa que ele ataca muito mais o vírus do que a célula hospedeira. E, assim, tem potencial para ser utilizado como fármaco no tratamento da doença.
| Paulo Ricardo da Silva Sanches |
 |
|
Composto denominado AG-hecate atua também em bactérias, fungos e células cancerosas e será testado contra os vírus da zika e da febre amarela (imagem: mecanismo de ação proposto para o AG-hecate. A figura mostra na parte superior (baixas concentrações do material): 1) HCV; 2) Interação do AG-Hecate com o envelope viral, destruição do vírus e liberação do material genético (+ssRNA); 3) Interação do AG-Hecate com a membrana da célula hospedeira e permeabilização do peptídeo; 4) Lipid Droplet; 5) Interação do composto com as Lipid Droplets, com consequente desestruturação das mesmas liberando as proteínas do complexo de replicação. E, na parte inferior (altas concentrações do material): 1) Interação do composto com a membrana plasmática da célula hospedeira e disrupção com consequente morte celular; 2) Interação com o envelope viral e destruição do vírus
|
“Apesar de o composto apresentar pequena atividade nos eritrócitos, os ‘glóbulos vermelhos’ do sangue, a molécula precisa passar por alterações em sua estrutura para reduzir ainda mais a sua toxicidade. É nisso que estamos trabalhando agora, para que a pesquisa possa evoluir da fase in vitro para a fase in vivo”, disse o pesquisador da Unesp.
Orientador do doutorado de Sanches, atual diretor do Instituto de Química da Unesp de Araraquara e que também contribuiu com o estudo, o professor Eduardo Maffud Cilli, disse que “o tempo médio para o planejamento e desenvolvimento de peptídeos terapêuticos é de 10 anos e até agora foram despendidos aproximadamente dois anos no desenvolvimento da molécula de AG-hecate. Considerando a média estatística, serão necessários mais oito anos antes que a droga chegue ao mercado.”
De acordo com Cilli, “a ótima notícia é que essa molécula não age apenas no HCV. Pode agir também em bactérias, fungos e células cancerosas. Além disso, como os vírus da zika e da febre amarela apresentam ciclos replicativos bastante parecidos com o do HCV, vamos testar a efetividade do AG-hecate também em relação a esses vírus”, disse.
No caso do câncer, a molécula interage e destrói a membrana da célula afetada. Aqui, a seletividade da ação do AG-hecate devese ao fato de que a célula modificada pelo câncer tem uma quantidade maior de cargas negativas na superfície do que a célula normal. E o peptídeo tem carga positiva. Então, a ação se dá por atração eletrostática. No caso do vírus, o mecanismo de ação da molécula é mais complexo, como mostra a ilustração.
Os estudos foram realizados no Laboratório de Síntese e Estudos de Biomoléculas do Instituto de Química da Unesp em Araraquara e no Laboratório de Estudos Genômicos do Instituto de Biociências, Letras e Ciências Exatas da Unesp em São José do Rio Preto.
Além dos citados, também participaram do estudo os pesquisadores Ana Cláudia Silva Braga, Bruno Moreira Carneiro, Guilherme Rodrigues Fernandes Campos e a professora Paula Rahal, orientadora do doutorado de Mariana Nogueira Batista.
A íntegra do artigo intitulado “GA-hecate antiviral properties on HCV whole cycle represent a new antiviral class and open the door for the development of broad spectrum antivirals” pode ser lida em aqui.
Com informações da Agência Fapesp
|
Síncrotron: concluída primeira etapa do Sirius
|
Divulgação CNPEM/LNLS
|
 |
Com a presença do presidente Michel Temer, foi realizada no dia 14 de novembro a cerimônia de entrega da primeira etapa do Sirius, a nova fonte de luz síncrotron do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), em Campinas (SP). Iniciado em 2012, o Sirius é o maior projeto da ciência brasileira, uma infraestrutura de pesquisa de última geração, estratégica para a investigação científica em áreas como saúde, agricultura, energia e meio ambiente.
Esta primeira etapa compreende a conclusão das obras civis e a entrega do prédio que abriga toda a infraestrutura de pesquisa, além da conclusão da montagem de dois dos três aceleradores de elétrons. O terceiro acelerador – e também o principal deles – está em processo de montagem.
Já a entrega da próxima etapa do projeto, prevista para o segundo semestre de 2019, inclui o início da operação do Sirius e a abertura das seis primeiras estações de pesquisa para pesquisadores. O projeto completo contemplará mais sete estações de pesquisa (denominadas “linhas de luz”), que deverão entrar em operação até 2021.
|
