Plantas gramíneas como o milho, o arroz e a cevada também produzem sideróforos, no caso chamados fitossideróforos, como a nicotianamina e o ácido mugineico, mostrados nas figuras abaixo. Essas substâncias são expelidas raízes das plantas e vão “dissolvendo” o mineral do solo diretamente em contato com elas.
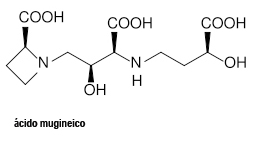
Figuras: Fórmulas estruturais de dois fitossideróforos
Sejam bacterianos ou de plantas, os sideróforos são, portanto, substâncias importantes para trazer o ferro para dentro da cadeia alimentar.
Existe uma outra estratégia para a absorção de ferro do ambiente, que é usada pelas plantas que não produzem fitossideróforos. Nas suas raízes, elas possuem proteínas que são capazes de converter íons férricos (Fe3+) em íons ferrosos (Fe2+), que são prontamente assimilados.
O ferro no organismo
Um adulto humano normal apresenta de 1,7 g (mulheres) a 2,4 g (homens) de ferro, estocado em diversos compartimentos biológicos. Cerca de 65% desse total integram a hemoglobina, que é a proteína de transporte de oxigênio (veja a Figura 3), presente nos glóbulos vermelhos do sangue. Uma molécula de hemoglobina tem quatro íons de ferro, cada um deles acondicionado em grupos chamados heme. Esses grupos têm por característica atrair as moléculas de oxigênio captadas nos pulmões.
Uma vez “carregada” com oxigênio, a hemoglobina é transportada pela circulação até chegar às células, onde transfere sua carga de oxigênio para uma proteína menor, parecida com ela, chamada mioglobina.
A mioglobina é também uma proteína que utiliza o ferro, neste caso, para receber o oxigênio vindo da hemoglobina. Após um período de aproximadamente 2 meses, os glóbulos vermelhos ficam velhos e são reciclados pelo próprio organismo, sendo que o ferro que deles se extrai é utilizado para a produção de novos glóbulos vermelhos.
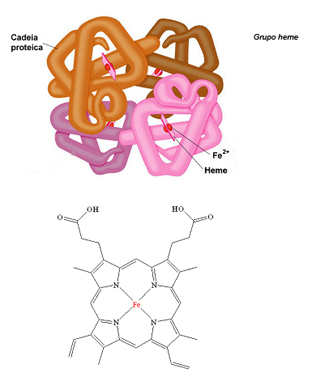
Estrutura simplificada da hemoglobina e fórmula estrutural do grupo heme que contém o íon Fe²+
O ferro é um elemento tão importante para a vida que o corpo humano não criou um mecanismo para eliminar eventuais excessos. Uma pessoa normal controla o balanço de ferro no momento da absorção: se seu organismo precisa desse elemento, ele é absorvido. Se não necessita, ele não chega a ser assimilado. Podemos perder ferro através da descamação da pele e da mucosa intestinal, sudorese, sangramentos ocasionais e, nas mulheres, pela menstruação. É por isso que devemos obtê-lo por meio da alimentação, sendo recomendada a dose diária de 18 miligramas desse elemento. Esse valor é uma média, ou seja, ele pode ser maior ou menor para uma determinada pessoa, dependendo do seu estado de saúde, da sua idade e até mesmo do seu estilo de vida.
Ao contrário de algumas plantas e das bactérias, o corpo humano não produz sideróforos, portanto, não pode “dissolver pedras” como fazem esses organismos. O corpo também não tem o poder de absorver o ferro diretamente do solo com eficiência. O ferro que absorvemos mais facilmente vem da dieta, sendo os alimentos ricos desse metal as carnes vermelhas, o peixe, a lentilha, o feijão, o espinafre e o frango. A forma química do ferro nesses alimentos, porém, pode variar muito, o que vai interferir com a sua absorção: o ferro de alimentos de origem animal é mais facilmente assimilável do que o de origem vegetal. Isso não significa, contudo, que os vegetarianos terão necessariamente problemas para manter um nível adequado de ferro no organismo.
É interessante destacar que, num organismo saudável, o ferro se encontra protegido sob formas químicas muito estáveis, sem traços desse elemento “livre”. Isso é muito importante, pois sendo o ferro tão cobiçado por diversos organismos, nosso corpo poderia ser infectado por muitos parasitas que se aproveitariam desse elemento caso ele não estivesse bem “acondicionado”, transformando nosso sangue em uma espécie de “caldo de cultura” para eles.
Existe no sangue uma proteína destinada a transportar o ferro desde o intestino até as células que dele necessitem, chamada transferrina. Poderia se pensar na transferrina como um “carro forte” que leva o metal precioso da sua fonte até o seu destino, sem permitir que ele seja perdido pelo caminho.
Doenças causadas pela falta de ferro
Existem diversos motivos pelos quais o organismo pode apresentar deficiência de ferro. Por exemplo, uma demanda aumentada pelo elemento (não suprida pela dieta), que tipicamente pode ocorrer durante o crescimento ou a gravidez, perdas grandes por sangramentos ou pela incapacidade do organismo de absorver ferro devido a problemas na mucosa intestinal.
A anemia ferropriva é uma forma comum de anemia provocada pela baixa ingestão de ferro, de tal forma que a hemoglobina não pode ser produzida. Essa forma de anemia é uma das principais desordens nutricionais do mundo moderno, afetando cerca de 37% da população mundial. Em algumas regiões do Brasil estima-se que até cerca de 80% das crianças apresentam esse problema, normalmente devido à falta de acesso a alimentos como carnes e peixes, concomitante ao consumo, às vezes exclusivo, de alimentos que contém ferro, mas em uma forma não muito acessível para o corpo (como grãos e vegetais). É por isso que não só no Brasil, mas em muitas partes do mundo, alimentos de uso comum, como as farinhas, são, por lei, fortificados com ferro (cerca de 4 miligramas por 100 gramas de farinha).
Doenças causadas pelo excesso de ferro
Um problema menos comum, mas importante, ocorre quando o ferro se encontra em excesso no organismo. A sobrecarga de ferro é uma condição clínica que se instala quando o organismo contém mais ferro do que necessita, ultrapassando a capacidade da transferrina sanguínea e ficando em formas químicas mais reativas. A sobrecarga de ferro pode ser diagnosticada tanto no sangue quanto nas células de alguns tecidos, como fígado, coração e cérebro.
A sobrecarga de ferro pode ser consequência de enfermidades, como a talassemia e a hemocromatose hereditária. A talassemia é uma doença genética que provoca a má-formação de hemoglobina e de glóbulos vermelhos, que são reprocessados pelo corpo muito mais rapidamente do que deveriam, e o ferro que sai desse processo não é prontamente reabsorvido em outros compartimentos do corpo. Podem ocorrer diferentes graus dessa anomalia, por isso os sintomas podem ir de um leve cansaço a problemas cardíacos sérios. Os portadores dessa doença tendem a ter a pele e/ou o globo ocular amarelados. Existem determinadas populações que apresentam maior frequência das mutações que provocam as talassemias, como os habitantes do norte e do leste da África, sul da Europa, Índia e sudeste asiático. No Brasil, é relativamente frequente entre negros e mulatos, pois seus ancestrais vieram de regiões da África onde essa mutação ocorria com frequência.
A hemocromatose hereditária é também uma doença de fundo genético, mas caracterizada pela disfunção nos mecanismos que controlam a absorção de ferro pelas células. Nos portadores dessa doença, o organismo não consegue parar de absorver o ferro da dieta, fazendo com que o elemento seja depositado no fígado, no pâncreas e no coração. A doença pode causar cirrose, câncer de fígado, insuficiência cardíaca e diabetes. A hemocromatose afeta principalmente a população caucasiana.
Além dessas duas doenças, a sobrecarga de ferro pode ser um efeito colateral de um regime de transfusão de sangue prolongado, pois cada bolsa de sangue contém cerca de 200 miligramas de ferro livre.
Como citado, o organismo não tem como eliminar o excesso de ferro, talvez até por uma estratégia de sobrevivência (sendo tão precioso, não há sentido evolutivo em desenvolver um meio de se livrar dele). Então, nos pacientes sobrecarregados, todo o ferro que se encontra fora dos compartimentos bioquímicos corretos (como por exemplo, ligado à transferrina ou à hemoglobina) pode ser disputado por outros organismos, e aí existe a chance de ocorrer infecções generalizadas.
É relativamente simples administrar a sobrecarga de ferro no organismo. O tratamento depende da condição clínica que originou a sobrecarga e pode ser aplicado pela combinação de métodos que envolvem a coleta de sangue, o controle no consumo de alimentos ricos em ferro ou a terapia de quelação.
A terapia de quelação é o tratamento do paciente com moléculas ou seus ânions que tenham grande afinidade por metais (conhecidas como quelantes) e que formam compostos inertes que são excretados. A terapia de quelação não é usada apenas para tratar sobrecarga de ferro, mas pode ser aplicada para qualquer tipo de intoxicação por metais, como mercúrio, chumbo, cobre e cádmio.
O primeiro quelante usado em terapia de quelação de ferro foi um sideróforo bacteriano, a desferrioxamina, conhecida pelo nome de Desferal®. Ela não é ativa quando administrada por via oral, e é rapidamente excretada pelo organismo, tendo, portanto, que ser administrada por longas infusões intravenosas. Há outros dois quelantes sintéticos ativos por via oral: a deferiprona (Ferriprox®) e o deferasirox (Exjade®), cuja fórmulas químicas são mostradas abaixo.
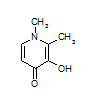
deferiprona (Ferriprox®)
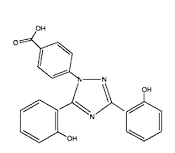
deferasirox (Exjade®)
Fórmulas estruturais de dois quelantes sintéticos empregados na terapia de quelação de sobrecarga de ferro
Considerações finais
O ferro é um elemento abundante e de grande importância biológica, embora seja pouco disponível para os microrganismos, que tiveram que desenvolver estratégias químicas sofisticadas para deixá-lo na forma adequada para ser metabolizado. O corpo humano capta ferro por meio da alimentação e o estoca em compartimentos químicos bem definidos para impedir a infestação por organismos competidores, e para bloquear a formação de espécies reativas de oxigênio. Problemas no metabolismo de ferro podem incluir sua falta (anemia ferropriva) ou excesso (sobrecarga de ferro). Enquanto o primeiro problema é facilmente corrigido através de uma alimentação adequada, o segundo requer o tratamento com substâncias que removam o ferro do corpo, conhecidas por quelantes.
--------------------------------------------------------------------------------
Ferro – Um elemento de “transição”
O ferro é o elemento de número atômico 26 com a seguinte distribuição eletrônica: 1s22s22p63s23p63d64s2. Por ter um orbital d não completamente preenchido (ou seja, com menos de 10 elétrons), o ferro é um dos elementos de transição. O termo “elemento de transição” foi usado pela primeira vez no início do século 20, e refere-se às propriedades químicas que vão gradualmente mudando pela ocupação sucessiva dos elétrons dos orbitais d desses elementos da esquerda para a direita na Tabela Periódica. (Figura 5).
A ocupação parcial da subcamada d faz com que os elementos de transição tenham propriedades semelhantes. Por exemplo, eles formam compostos coloridos, podem ter propriedades magnéticas, e se apresentam em vários estados de oxidação. No caso do ferro, além do átomo de carga neutra (Fe0; o ferro metálico usado por exemplo na construção civil), ele pode se apresentar com as cargas +2 (Fe2+; íon ferroso) ou +3 (Fe3+; íon férrico). Sais ferrosos normalmente são esverdeados, enquanto que sais férricos são amarelados.
